
En 2016, se actualizó el Capítulo[2] de la USP[1] “<1207> Evaluación de la integridad del envase – productos estériles”, cuestionando seriamente el uso exclusivo de métodos históricos como las pruebas azules o las pruebas microbiológicas. En este capítulo, el método microbiológico se denomina “Desafío microbiano, exposición por inmersión” y el método azul se incluye en los métodos denominados “Líquido trazador”. Estos dos métodos se clasifican como “métodos probabilísticos”. Los métodos probabilísticos se caracterizan por la naturaleza aleatoria de los fenómenos que permiten el paso del líquido a través de las muestras. Por el contrario, la USP define los “métodos deterministas” como técnicas fisicoquímicas que permiten obtener resultados cuantificables y reproducibles con límites de detección claramente definidos y predecibles.
En ambos casos, el método microbiológico o el azul, el principio básico es similar. Se trata de detectar el paso de un líquido en el interior de un recipiente. El paso del líquido se detecta mediante tinción o crecimiento microbiano.
Aquí veremos el método del azul de metileno.
Método de ensayo del azul de metileno o Dye Ingress
Las muestras se llenan primero de producto. También puede probarse una muestra vacía, pero generalmente se favorece el paso entre dos líquidos. A continuación, las muestras se sumergen en una solución colorante.
Para mejorar la penetración del colorante, las muestras se someten a vacío durante un tiempo determinado; a continuación, se deja que el producto vuelva a la presión atmosférica y se deja transcurrir el tiempo de penetración. Esta es la etapa más importante de la prueba.
Pueden utilizarse diversos colorantes, históricamente la solución de azul de metileno (la mayoría de las veces soluciones dosificadas a 1g/L). Al final del ciclo de prueba completo, se limpian las muestras y se procede a su lectura. Las muestras pueden leerse visualmente o utilizando un espectrofotómetro. Si alguna de las muestras muestra coloración interna, la muestra se declara como fuga.
Controles positivos y límites de detección
Paralelamente a las pruebas, deben realizarse controles positivos con muestras en las que se practiquen “agujeros”.
El uso de muestras en lugar de controles estándar permite simular realmente la prueba. En comparación con algunos métodos deterministas, la utilización de controles positivos permite volver a comprobar el límite de detección en la muestra real en cada sesión de prueba.
Tenga en cuenta que los límites de detección varían en función del tipo de recipiente. Cuanto mayor sea el recipiente (varios litros, por ejemplo), mayor será el límite de detección. El límite de detección está correlacionado con la capacidad del líquido para penetrar en el recipiente.
Por ejemplo, para una bolsa de líquido flexible de 20 litros, el límite de detección será generalmente superior a 100μm, mientras que para una jeringa o un acon de algunos mililitros, el límite de detección puede bajar a 30μm con variaciones de presión suficientemente fuertes.
Para generar los controles positivos, se pueden utilizar microtubos o microcapilares para simular los microagujeros de las muestras.
La creación de controles positivos es una tarea delicada. Durante la preparación y luego durante la inserción de los capilares en las muestras, es importante no obstruir los capilares ni romperlos.
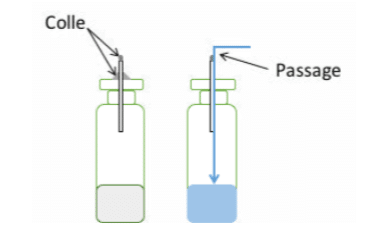
Otro punto esencial es la fijación de los capilares. Si un capilar no está sellado o no está correctamente sellado a la muestra, el líquido fluirá más allá que dentro de él (véase la figura 1), incluso si el capilar está insertado en un tapón de goma.
El tapón de goma no se contrae perfectamente alrededor del capilar, dejando un paso para el líquido. Hay que tener en cuenta que también existe una correlación entre la longitud de los capilares y la probabilidad de paso a través de ellos, de ahí la necesidad de realizar una validación antes de emprender ensayos de rutina.
Ventajas e inconvenientes de este método
Este método tiene una serie de desventajas bien conocidas:
- Se trata de un método “destructivo” y las muestras no deben reutilizarse,
- Directamente relacionado con el punto anterior, hay que gestionar los residuos generados y tener cuidado con los productos manchados con azul de metileno.
- Los límites de detección son relativamente altos, pero pueden mejorarse aplicando grandes variaciones de presión,
- El tiempo de análisis es largo: la mayoría de las veces, el azul necesita al menos 30 minutos para penetrar.
A pesar de estos inconvenientes, este método sigue siendo ventajoso en muchos casos:
- Funciona igual de bien en volúmenes pequeños y grandes, y también en envases de distintas formas y sellados con distintos métodos.
- Su instalación es bastante sencilla y no requiere equipos caros.
[1] PDA, Development of a Dye Ingress Method to Assess Container-Closure Integrity: Correlation to Microbial Ingress
[2] USP: The U.S. Pharmacopeial Convention





